基礎研究
教室の方針として、大学院生が実験専属とする期間を確保できるようなシステム作りを進めています。これを受けて、2022年4月より90期千葉 龍平先生が北大薬学部小川美香子先生ラボへ出向し、研究を開始しています。
研究
Research

教室の方針として、大学院生が実験専属とする期間を確保できるようなシステム作りを進めています。これを受けて、2022年4月より90期千葉 龍平先生が北大薬学部小川美香子先生ラボへ出向し、研究を開始しています。
当科が責任施設,関連施設となっている臨床試験を紹介します。
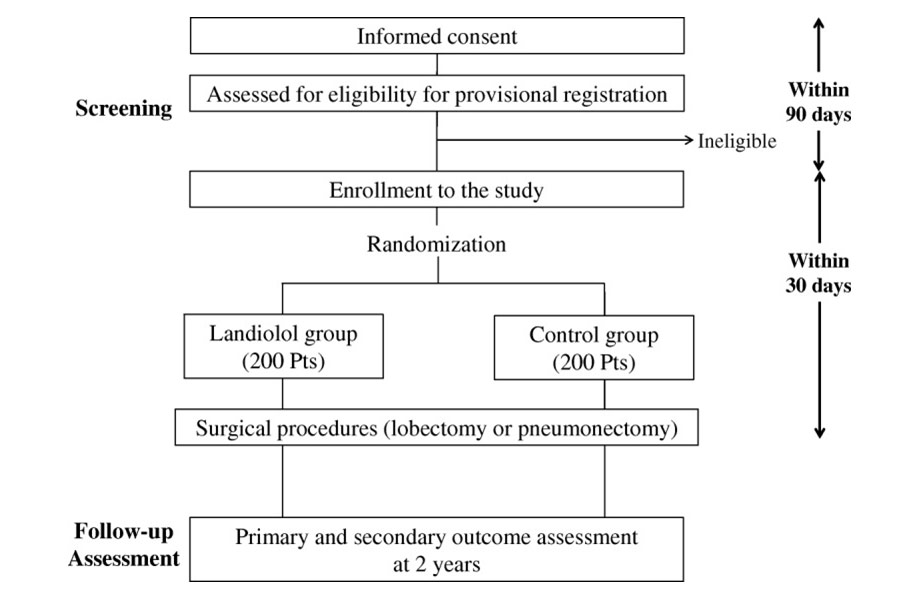
糖タンパク質MUC1は、悪性化に伴いムチン上の糖鎖構造が変化し、正常細胞では検出されない単純で短い糖鎖抗原の発現が認められることが知られています(下図左)。我々はこれまでの研究で、MUC1がん特異的糖鎖抗原の一つであるMUC1-Tnが肺腺癌の約25%に発現しており、かつ予後予測マーカーとなり得ることを示しました。
https://pubmed.ncbi.nlm.nih.gov/33574941/
一方、近赤外光線免疫療法(Near Infrared Photoimmunotherapy: NIR-PIT)は、抗体に水溶性の光物質であるIRDye 700Dx(IR700)を接合し、近赤外光線を照射することで腫瘍細胞を破壊する治療です。本研究では独自に作製したMUC1がん特異的糖鎖抗原のみを選択的に認識する新規モノクローナル抗体による「抗体-IR700結合体」を用いた近赤外光線免疫療法(下図右)を確立し、さらに近赤外線照射後に起こる腫瘍深部へのナノ粒子の運搬増強効果を応用して「腫瘍ホーミングペプチド含有ナノ粒子によるsmall interfering RNA送達」を併用し、新規の肺がん治療法の開発を目指すものです。
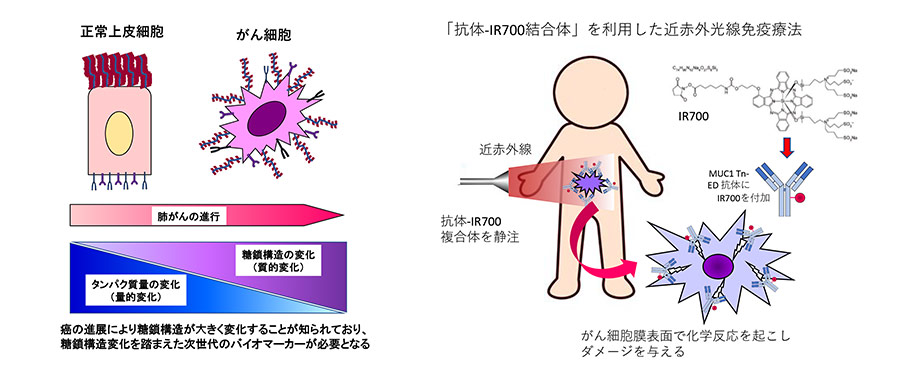
CD44はヒアルロン酸をはじめとする細胞外マトリックスと結合する接着分子であり、癌細胞増殖・転移などに深く関与しており、肺癌などにも多く発現し、がん幹細胞マーカーとしても知られています(下図)。昨今、NIR-PITは局所の腫瘍に対する、直接の殺細胞効果のみならず、転移巣などへも間接的に作用するアブスコパル効果が注目されています。そこで、我々はCD44を標的とした「CD44抗体-IR700結合体」を利用したNIR-PITの開発に着眼し、マウス肺癌同所性モデルに対するアブスコパル効果を検討しています。また、頭頸部癌や、食道癌のように、腫瘍が外部ないし管腔に露出した病変だけでなく、深部に位置しており治療困難な胸部悪性腫瘍の治療にも活用できる近赤外蛍光でのイメージングと治療を同時に行える細径ファイバースコープの開発を目指しています。
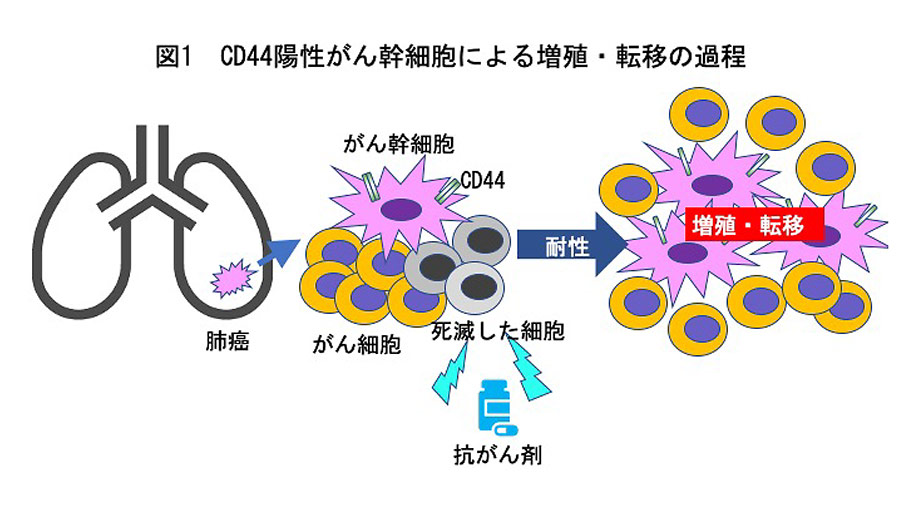
がん微小環境において、低酸素状態下ではATPからAMPを介しアデノシンを生成するCD39/CD73カスケード分子の発現が誘導され、さらにアデノシンはリンパ球上のA2受容体を介して免疫抑制状態を誘導することから、免疫チェックポイント阻害(ICI)療法に対し抵抗性を示します(下図)。我々は臨床検体を用いた研究で、非小細胞肺癌(NSCLC)の一部でCD73発現が亢進し、またPD-L1発現と相関することを明らかにし、本経路の遮断が、有望ながん免疫療法の治療標的となり得ることを示しました。今後、マウス肺癌モデルを用いたCD73を標的としたIR700結合体を利用した近赤外光線免疫療法およびICIとの併用療法の検証を行い、近赤外線照射後に起こるいわゆる「免疫原性細胞死」によりがん自己免疫の活性化を促し、さらにCD73を遮断することで免疫抑制状態にある肺癌に対し、がん免疫の再活性化を誘導することを期待しています。
肺移植は末期呼吸不全に対する根治的治療法であるが、移植肺に対する慢性拒絶は、長期生存を妨げる最大の要因であり、有効な治療法は確立されておりません。肺移植後の安定した長期成績のためには、慢性拒絶を誘発しない新たな免疫抑制法の確立が重要な戦略となります。Primary Graft Dysfunction (PGD)は、移植後早期の移植肺における強い炎症反応や虚血再灌流障害を含めた自然免疫応答により引き起こされる病態であり、移植後の短期成績に重大な影響を与えるのみならず、その後の獲得免疫応答にも強く影響し、慢性拒絶をも引き起こすことが知られています。臓器提供が極端に少ない本邦にあっては、安定した肺移植の長期成績のためには、PGDの有効な予防法、治療法の確立が必要です。本研究は、PGDに対する新規治療法として、細胞移植時の抗炎症効果、細胞保護効果が確認されている新規Erythropoietin analogue(ARA 290: cibinetide)を用いた新規免疫抑制法を肺移植へ応用し、臨床応用へ繋げることを目的としています。
本研究の最終的な目的は、肺腫瘍の血管新生と血流を利用し、ICGを静脈投与し腫瘍へICGを集積させ、蛍光波長測定装置を用いて検出し腫瘍同定を行うものです。これまでの研究で、肉眼では捉えられない蛍光波長を検出することで、より肺表面から深い位置にある腫瘍の位置も同定できる可能性を示しました(Chiba R, et al. A novel system for analyzing ICG fluorescence spectra enables deeper lung tumor localization during thoracoscopic surgery, Journal of Thoracic Disease 2022, in press)。現在、基礎的実験まで終了し、今後臨床試験を計画しています。
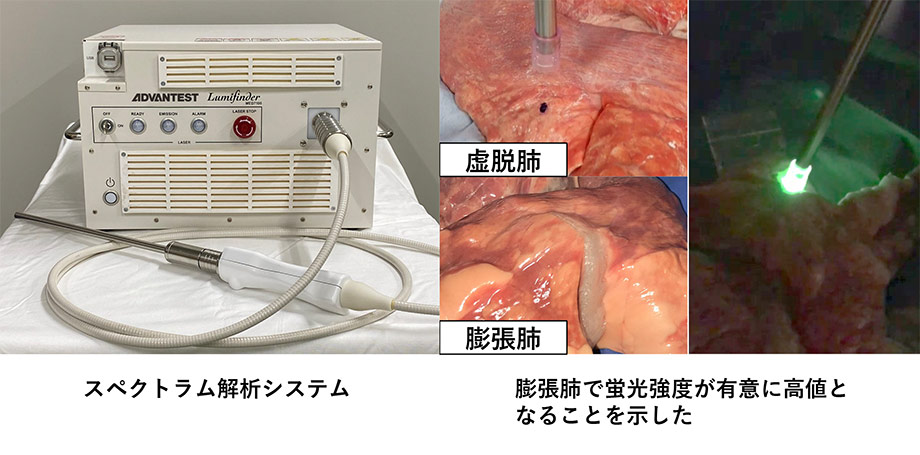
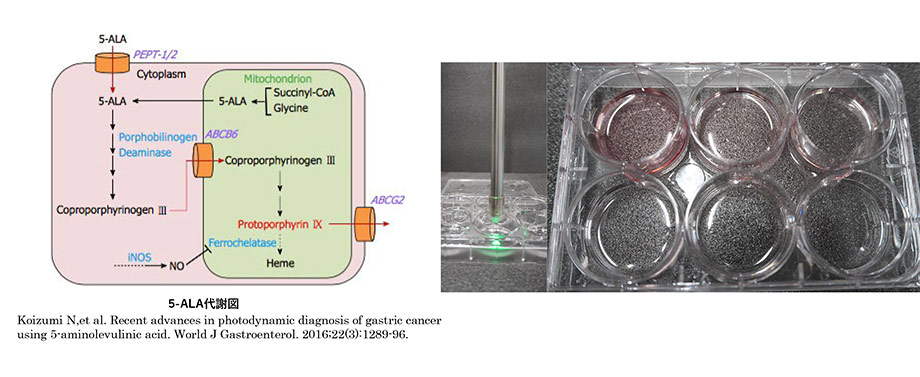
本研究では、肺腫瘍同定のための簡便かつ低侵襲な方法として、5-アミノレブリン酸(5-ALA)および近赤外光スペクトル測定装置を用いた同定方法の有用性を検証します。近赤外光スペクトル測定装置は、肉眼では認識できない近赤外光の波長とその強度を検知することができ、5-ALAにおいてもその有効性を示し実用化することで、従来の方法よりも低侵襲で、確実性の高い胸腔鏡下手術における腫瘍同定方法の確立を目指します。本研究も現在、基礎的実験まで終了し、今後臨床試験を計画しています。
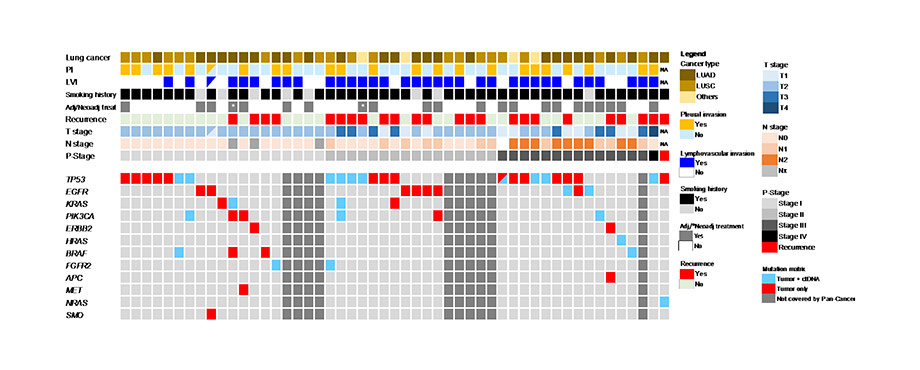
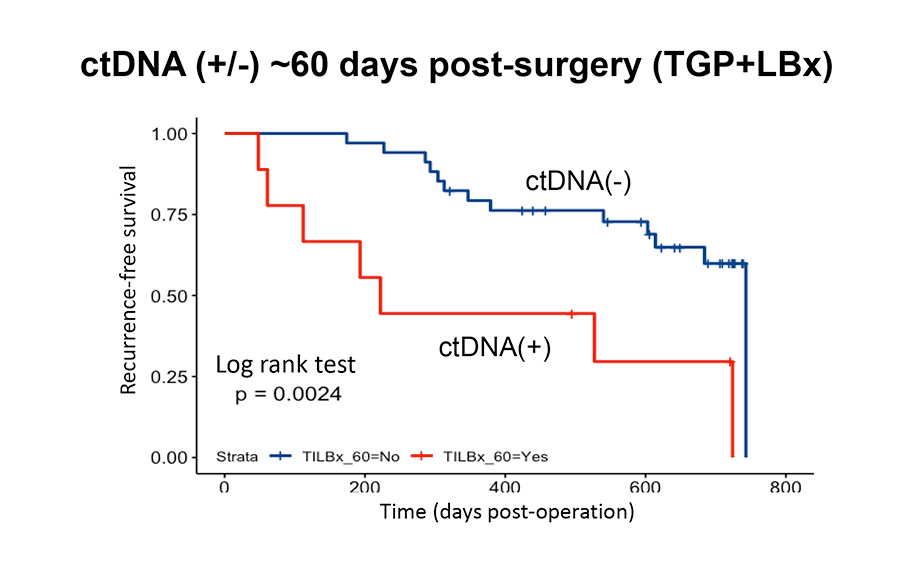
悪性腫瘍と診断され、手術・抗悪性腫瘍薬などによる治療を施行した患者を対象に、Liquid biospyによる遺伝子変異検索により治療選択に有効な指標となり得るか(ドライバー遺伝子変異などの遺伝子異常を検出し有効な治療を推定できるか)また、治療効果のモニタリングに有用か(遺伝子変異を伴うセルフリーDNA=ctDNAを検出し、腫瘍量を推定できるか)について、がん研有明病院、札幌医大との共同研究を行っています。末梢血を採取し、体細胞遺伝子変異及びRNA解析を行い、必要な場合は腫瘍組織を用いて同様の解析を行います。解析の方も着々と進んでおり、手術前後でctDNAによるモニタリングを行い、術後再発モニタリング法として有望な結果が出始めています(下図)。肺がん手術を受けられた方の術後のがん遺伝子変異の検索とそれに伴う治療の個別化をより多くの人に簡略に行えるようになることが本研究の最終目標です。
高い技術を要する胸腔鏡手術の若い外科医への手術手技教育、あるいは高難度手術である気管分岐部形成などの呼吸器外科手術および肺移植手術を安全に施行するには、解剖学的知識の習得と外科チーム全体での手技の流れの把握が必須です。私たちは、北海道大学病院Cadaveric Anatomy and Surgical Training (CAST) 実施運営委員会の承認を得た上で、安全な呼吸器外科手術治療の確立における献体を用いた手術手技トレーニングの有用性を検討しています。昨年度はCovid-19の影響により院内の先生のみを対象とし、2月6日(テーマ:「Hemi-clamshell approach」「緊急時の血管確保」「気管支形成・肺動脈形成術」)と2022年2月20日(テーマ:「肺移植トレーニング」)に手術手技セミナーを開催しました(下図)。
手術においてがんの完全切除がなされ、その後、術後補助化学療法が実施された非小細胞肺がん患者を対象に、大学発のがん治療用ワクチンの第2相医師主導治験を多施設共同で行っています。今回の治験で用いられるがんワクチンは、肺がん細胞で高頻度に発現する複数の抗原を標的としています。これまでのがんワクチンの開発研究から、患者ごと、およびがん細胞ごとに抗原の発現パターンが異なるがんの不均一性(heterogeneity)や患者ごとに異なる各ペプチドに対する免疫応答が認識されており、複数の種類の抗原由来ペプチドを含むがんワクチンでは、より幅広い患者で効果を発揮することを目指しています。本治験は、6機関が医師主導治験を実施し、肺がんに対する新たな治療法の開発を進めています。
現在は既に投与期間は終了し、予後解析中です。
本試験はこれまで心房細動などの治療に用いられてきたβブロッカーであるLandiolol(オノアクト)を周術期に投与して肺癌の再発予防効果を検証し、「肺癌転移予防薬」という新しいカテゴリーの薬剤として薬事承認を狙ったいわゆる「ドラッグ・リポジショニング」を狙った全国12施設からなる多施設共同試験で、治験薬投与群、手術単独群それぞれ200例、合計400例のランダム化比較試験です。Landiololの肺癌再発予防は手術中に増加する循環腫瘍細胞の転移標的臓器の血管内皮細胞接着を防止することができるという仮説を立てています。コロナ禍の影響を受けて症例登録のペースが鈍りましたが、2021年にすでに症例登録が終了して2023年には結果を発表できる予定です。